Виявляється, у насиченої пари та бізнес-центру багато спільного, а щоб закип’ятити чайник при температурі менше 100 ° C, потрібно забратися на Ельбрус.
Фазові переходи: зміна агрегатних станів речовини
Перш ніж говорити про насичену пару, потрібно освіжити знання про агрегатні стани та фазові переходи між ними. Якщо ви забули, які бувають агрегатні стани, то можете збігати в нашу статтю про них.
При зміні зовнішніх умов (наприклад, якщо внутрішня енергія тіла збільшується або зменшується через нагрівання або охолодження) можуть відбуватися фазові переходи – зміни агрегатних станів речовини.
Ось які бувають фазові переходи:
- Перехід з твердого стану в рідкий – плавлення;
- Перехід з рідкого стану в твердий – кристалізація;
- Перехід із газоподібного стану в рідкий – конденсація;
- Перехід з рідкого стану в газоподібний – пароутворення;
- Перехід із твердого стану в газоподібний, минаючи рідкий – сублімація;
- Перехід із газоподібного стану в твердий, минаючи рідкий — десублімація.
На схемі – назви всіх фазових переходів:
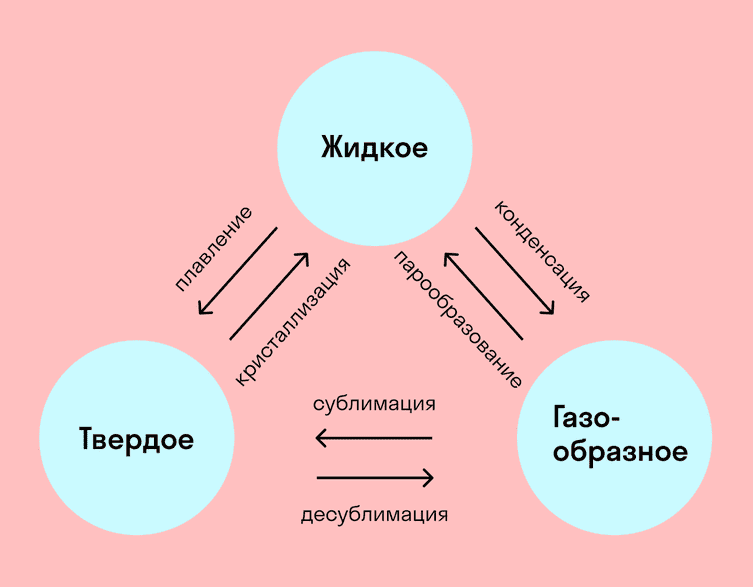
Фазові переходи – важлива штука. Все живе на Землі існує лише завдяки тому, що вода вміє перетворюватися на лід чи пару. З кристалізацією, плавленням, пароутворенням та конденсацією пов’язані багато процесів у металургії та мікроелектроніці.
Пароутворення
Отже, пароутворення — це перехід з рідкого стану в газоподібний.
При пароутворенні завжди відбувається поглинання енергії: до речовини необхідно підводити теплоту, щоб вона випаровувалась. Через це внутрішня енергія речовини збільшується.
У процесу пароутворення є два різновиди: випаровування та кипіння.
- Випарювання — це перетворення або перехід рідини на газ (пар) з вільної поверхні рідини. Якщо поверхня рідини відкрита і з неї починається перехід речовини з рідкого стану в газоподібний, це буде називатися випаровуванням.
- Кипіння — процес інтенсивного пароутворення, що відбувається в рідині за певної температури.
Наприклад, ми заварили гарячий чай. Над чашкою ми побачимо пару, тому що вода щойно взяла участь у процесі кипіння.
Зачекайте, адже ми щойно сказали, що кипіння і випаровування — різні речі. Це дійсно так, але при цьому обидва процеси можуть відбуватися паралельно.
Випар може відбуватися і без кипіння, просто тоді воно не буде для нас помітним. Наприклад, вода в озері випаровується, хоч ми цього й не помічаємо. Кипіння по суті своїй — це інтенсивне випаровування, яке викликали зовнішніми умовами — довівши речовину до температури кипіння.
Фізика пояснює випаровування тим, що рідина зазвичай трохи холодніша за навколишнє повітря, і через різницю температур відбувається випаровування.
Якщо немає якихось зовнішніх впливів, випаровування рідин відбувається вкрай повільно. Молекули залишають рідину через явища дифузії.
| Напрямок теплових потоків при випаровуванні може йти в різній послідовності та комбінаціях: |
Підсумуємо, щоб не заплутатися, в чому головна різниця між випаром і кипінням:
| Випарювання | Кипіння |
|---|---|
|
|
Температура кипіння
При температурі кипіння тиск насиченої пари стає рівним зовнішньому тиску на рідину – найчастіше це атмосферний тиск. Значить, що більший зовнішній тиск, то при вищій температурі почнеться кипіння.
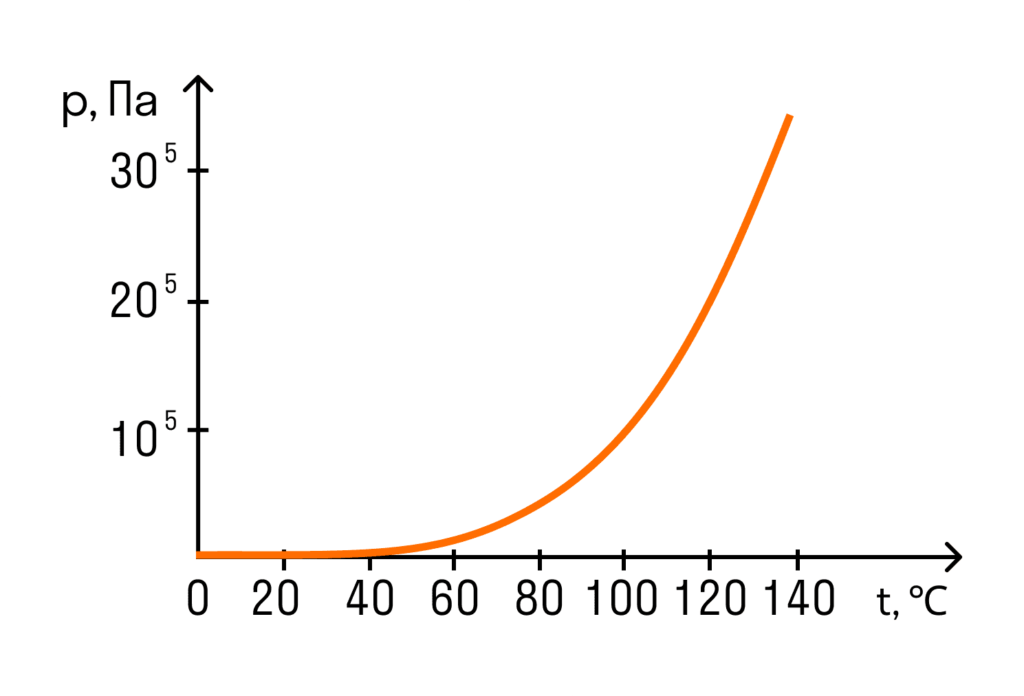
При нормальному атмосферному тиску, приблизно дорівнює 100 кПа, температура кипіння води дорівнює 100°C. Тому можна відразу сказати, що тиск насиченої водяної пари при температурі 100 градусів за Цельсієм дорівнює 100 кПа. Це знадобиться при вирішенні завдань.
Чим вище ми піднімаємося, тим меншим стає атмосферний тиск, тому що маса атмосфери над нами зменшується. Так, наприклад, на вершині Ельбрусу атмосферний тиск становить 5×104 Па — у два рази менше, ніж нормальний атмосферний тиск. Тому температура кипіння на вершині Ельбруса буде нижчою, ніж на рівні моря. Вода там закипить за температури 82°C.
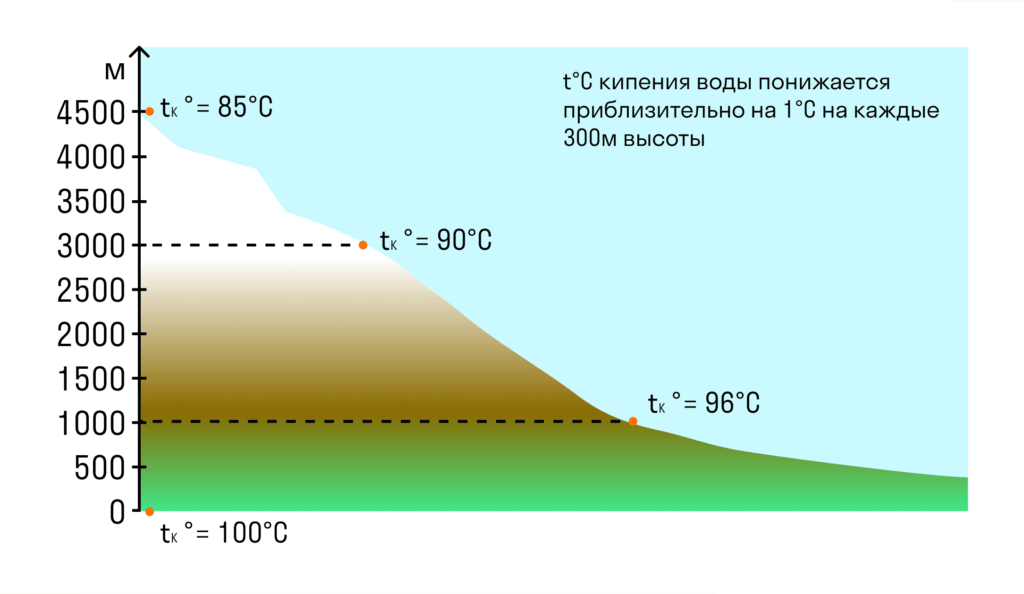
Температура кипіння при нормальному атмосферному тиску — це строго певна величина для кожної рідини.
| t, °C |
Речовина |
|---|---|
-253 -183 35 78 100 357 3050 4200 5657 | водень кисень ефір спирт вода ртуть залізо графіт вольфрам |
Випаровування та конденсація
Молекули в рідині безперервно та хаотично рухаються. Це означає, що напрямок руху окремо взятих молекул — це випадкові напрямки. У цьому рідина зберігає свій обсяг. Також молекули силами тяжіння притягуються одна до одної, через що не можуть залишити рідину.
Значення швидкостей молекул є випадковими. Через це серед усіх молекул обов’язково є ті, що рухаються дуже швидко. Якщо така молекула опиниться поблизу поверхні розділу рідини та навколишнього середовища, то її кінетична енергія може досягти великого значення, і молекула залишить рідину.
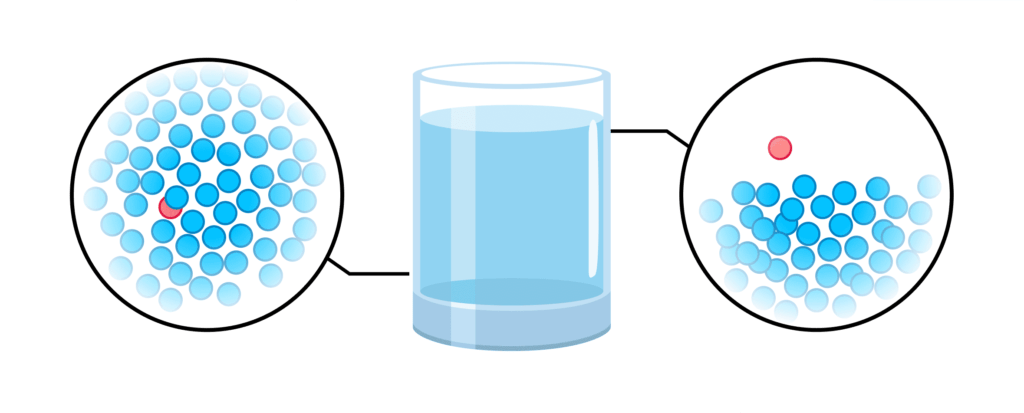
Власне, саме так відбувається процес випаровування (ми говорили про нього вище, коли йшлося про фазові переходи). Коли молекул, що випарувалися, стає багато, утворюється пара.
Зворотний процес також можливий: молекули, що вирвалися за межі рідини, повернуться в рідину. Це конденсація, про неї ми теж говорили. Якщо відкрити посудину з рідиною, то молекули, що випарувалися, залишатимуть простір над рідиною і не повертатимуться назад. Кількість рідини таким чином зменшуватиметься. Тобто рідина випаровується, а пара назад не конденсується (бо молекули цієї пари віддаляються від рідини) — так відбувається висихання.
Випаровування може відбуватися з різною швидкістю. Чим більше сили тяжіння молекул одна до одної, тим менша кількість молекул в одиницю часу виявиться в змозі подолати ці сили тяжіння і вилетіти назовні, і тим менша швидкість випаровування.
Швидко випаровуються такі рідини, як ефір, ацетон, спирт. Через це їх іноді називають летучими рідинами. Повільніше – вода. Набагато повільніше води випаровуються олія і ртуть.
Визначення насиченої пари
Залишимо склянку води на столі і замірятимемо рівень води в ньому щодня. Якщо записати ці вимірювання і порівняти їх, стане очевидним: рівень води став меншим, тобто вода випарувалася.
Тепер давайте накриємо склянку зверху. Молекули пари вже не зможуть залишати простір над рідиною, у міру випаровування їхня кількість почне зростати, а отже, зростатиме і кількість молекул, які конденсуються в одиницю часу.
Спочатку кількість молекул, що конденсуються за одиницю часу, буде менше кількості випаровуються молекул. Але в міру зростання концентрації пари (тобто збільшення кількості молекул в одиниці об’єму пари) потік молекул, що конденсуються, зросте. Це призведе до стану, що називається динамічною рівновагою.
Пар, що знаходиться в динамічній рівновазі, називають насиченим.
Уявіть собі величезний бізнес-центр із не менш величезними дверима. У співробітників бізнес-центру різний графік роботи, тому люди одночасно заходять у будівлю та виходять із неї у довільній кількості. Припустимо, о 6-й годині вечора 100 людей заходять у будівлю, щоб потрапити на ділову зустріч, а інші 100 людей вже закінчили працювати та йдуть додому. Кількість тих, хто заходить у бізнес-центр і виходить із нього, буде однаковим — це і є стан насичення.
| Значення тиску насиченої пари та її щільності є максимальними при заданому значенні температури. Якщо це не так, то пара ненасичена. |
Властивості насиченої пари
- При постійній температурі щільність насиченої пари не залежить від її обсягу .
Уявіть, що об’єм посудини з насиченою парою зменшили, не змінивши температури.
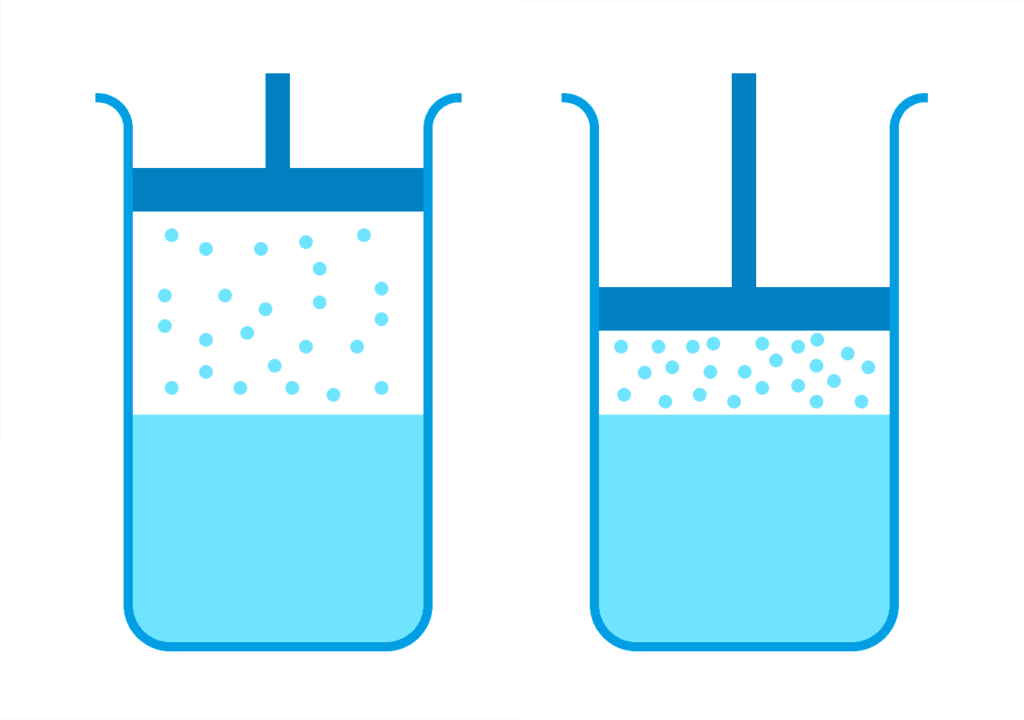
Кількість молекул, що переходять від пари до рідини, перевищить кількість молекул, що випаровуються, але при цьому частина пари сконденсується, а пар, що залишився, знову прийде в динамічну рівновагу. У результаті щільність цієї пари дорівнюватиме початковій щільності.
- Тиск насиченої пари не залежить від його об’єму.
Це пов’язано з тим, що тиск та щільність пов’язанічерез рівняння Менделєєва-Клапейрона, і випливає з першої властивості насиченої пари.
До речі, рівняння Менделєєва-Клапейрона справедливе для насиченої пари. При цьому потрібно бути уважним із окремими випадками. Так, наприклад, закон Бойля-Маріотта для насиченої пари не виконується.
| Рівняння Менделєєва-Клапейрона pV = νRT p — тиск газу [Па] V – об’єм [м3] ν – кількість речовини [моль] T – температура [К] R — універсальна газова стала R = 8,31 м2 × кг × с -2 × К-1 × моль-1 |
- При незмінному об’ємі щільність насиченої пари зростає з підвищенням температури і зменшується зі зниженням температури.
У початковий момент випаровування динамічна рівновага буде порушена (деяка частина рідини випарується додатково). Щільність пари буде зростати, поки динамічна рівновага не відновиться.
- Тиск і температура насиченої пари зростають швидше, ніж за лінійним законом, справедливим для ідеального газу.
У разі ідеального газу зростання тиску зумовлене лише зростанням температури, а у випадку з насиченою парою мають значення два фактори: температура та маса пари.
У разі нагрівання насиченої пари молекули починають ударятися частіше, тому що їх загалом стало більше, тому що пара побільшала.
Головна відмінність насиченої пари від ідеального газу: пара сама по собі не є замкнутою системою, а знаходиться в постійному контакті з рідиною.
Вирішення задач на тему «Насичена пара»
Застосуємо властивості насиченої пари під час вирішення задач.
Завдання раз
У циліндричній посудині під поршнем тривалий час знаходяться вода та її пара. Поршень починають всувати у посудину. При цьому температура води та пари залишається незмінною. Як змінюватиметься при цьому маса рідини в посудині? Відповідь поясніть.
Рішення
Оскільки пара і вода знаходяться в контакті тривалий час, пара є насиченою. При зменшенні обсягу судини тиск насиченої пари не змінюється. З рівняння Менделєєва-Клапейрона випливає, що для того, щоб тиск пари не змінювався, його кількість речовини (а значить і маса) має зменшуватися.
pV = νRT
У цьому процесі відбувається конденсація, частина молекул пари переходять у рідину, тому маса рідини збільшується.
Відповідь
Маса рідини збільшується.
Завдання два
Яка щільність насиченої пари при температурі 100°С?
Рішення
При нормальному тиску (p = 105 Па) 100°С — це температура кипіння води. Отже, тиск насиченої пари за цієї температури дорівнює атмосферному тиску.
Знайдемо зв’язок між тиском і щільністю через рівняння Менделєєва-Клапейрона.

Підставимо значення тиску в рівняння стану ідеального газу, попередньо перевівши температуру в Кельвіни: T = 100 + 273 = 373 K






