Наливаєте склянку соку і додаєте туди лід, миєте склянку водою, а потім можна ще пором обдати, щоб склянка була чистою. У цьому процесі тричі використовується вода, але у різних агрегатних станах. Давайте розбиратися в яких.
Агрегатні стани речовини
Щоб розібратися з тим, якими бувають агрегатні стани, пропоную по ходу читання статті заповнювати таблицю.
|
Агрегатні стани |
Властивості |
Розташування молекул |
Відстань між молекулами |
Рух молекули |
Твердий | ||||
Рідкий | ||||
Гази |
Лід, вода і водяна пара — це всі три агрегатні стани однієї речовини. Лід – твердий стан, вода – рідка, пара – газоподібне. Для кожної речовини існує три стани.
Твердий стан
Його дуже легко уявити — це будь-який предмет, який ми зустрічаємо в житті. У цьому стані тіло зберігає форму та обсяг. Відстань між молекулами приблизно дорівнює розміру самих молекул, які, у свою чергу, розташовані дуже структуровано.
Така структура називається кристалічною решіткою – через чітку структуру молекулам складно рухатися, і вони просто коливаються біля своїх положень рівноваги.
Заповнюємо нашу табличку
Агрегатні стани | Властивості | Розташування молекул | Відстань між молекулами | Рух молекули |
Твердий | зберігає форму та об’єм | в кристалічній решітці | співвідноситься з розміром молекул | коливається біля свого положення в кристалічній решітці |
Рідкий | ||||
Гази |
Рідкий стан
У цьому вся стані зберігається об’єм, але з зберігається форма. Наприклад, якщо перелити молоко зі глека в склянку, то молоко, що мало форму глека, набуде форми склянки. До речі, в корові у молока теж була інша форма.
Відстань між молекулами в рідкому стані трохи більша, ніж у твердому, але все одно невелика. При цьому частки не зібрані в кристалічні ґрати, а розташовані хаотично. Молекули майже не рухаються, але при нагріванні рідини роблять це більш охоче.
Згадайте, що відбувається, якщо залити чайний пакетик холодною водою — він майже не заварюється. А ось якщо налити окріп, чай точно буде готовий.
Заповнюємо таблицю
Агрегатні стани | Властивості | Розташування молекул | Відстань між молекулами | Рух молекули |
Твердий | зберігає форму та об’єм | в кристалічній решітці | співвідноситься з розміром молекул | вагається біля свого становища в кристалічній решітці |
Рідкий | зберігає об’єм | хаотично | близько один до одного | малорухливі, при нагріванні швидкість руху молекул збільшується |
| Гази |
Газоподібний стан
У житті ми зустрічаємо газоподібний стан речовини, коли відчуваємо запахи. Запах дуже легко поширюється, тому що газ не має ні форми, ні об’єму (він займає весь наданий йому об’єм), складається з молекул, що хаотично рухаються, відстань між якими більша, ніж розміри молекул.
Агрегатні стани | Властивості | Розташування молекул | Відстань між молекулами | Рух молекули |
Твердий | зберігає форму та об’єм | в кристалічній решітці | співвідноситься з розміром молекул | вагається біля свого положення в кристалічній решітці |
Рідкий | зберігає об’єм | хаотично | близько один до одного | малорухливі, при нагріванні швидкість руху молекул збільшується |
Гази | займають наданий об’єм | хаотично | більше розмірів молекул | хаотичний та безперервний |
Агрегатних станів точно три? Насправді, є ще четвертий – плазма. Звучить, як щось із наукової фантастики, але це просто іонізований газ — газ, у якому крім нейтральних частинок є ще й заряджені. Іонізатори повітря будуються на принципі переходу з газоподібної речовини в плазму.
З агрегатними станами розібралися, ура! Але досі неясно, як у кожної речовини їх цілих три, і як одна переходить в іншу. Для цього дізнаємось, що таке фазові переходи.
Фазові переходи: зміна агрегатних станів речовини
При зміні зовнішніх умов (наприклад, якщо внутрішня енергія тіла збільшується або зменшується внаслідок нагрівання або охолодження) можуть відбуватися фазові переходи — зміни агрегатних станів речовини.
Фазові переходи цікаві тим, що все живе на Землі існує лише завдяки тому, що вода вміє перетворюватися на лід чи пару. З кристалізацією, плавленням, пароутворенням та конденсацією пов’язані багато процесів металургії та мікроелектроніки.
На схемі – назви всіх фазових переходів:
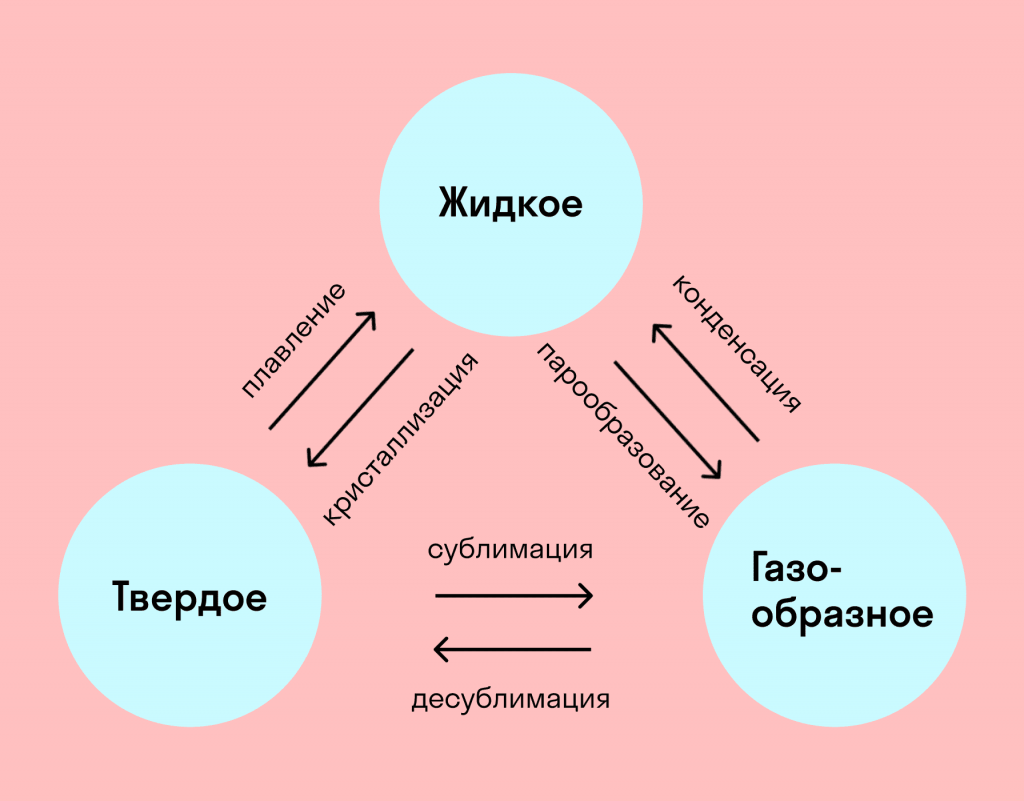
- Перехід з твердого стану в рідкий – плавлення;
- Перехід з рідкого стану в твердий – кристалізація;
- Перехід з газоподібного стану в рідкий – конденсація;
- Перехід з рідкого стану в газоподібний – пароутворення;
- Перехід з твердого стану в газоподібний, минаючи рідкий – сублімація;
- Перехід з газоподібного стану в твердий, минаючи рідкий – десублімація.
Графік фазових переходів
Якщо взяти процес перетворення льоду на воду, води — на пару, і зворотні дії, ми отримаємо дуже інформативний графік.
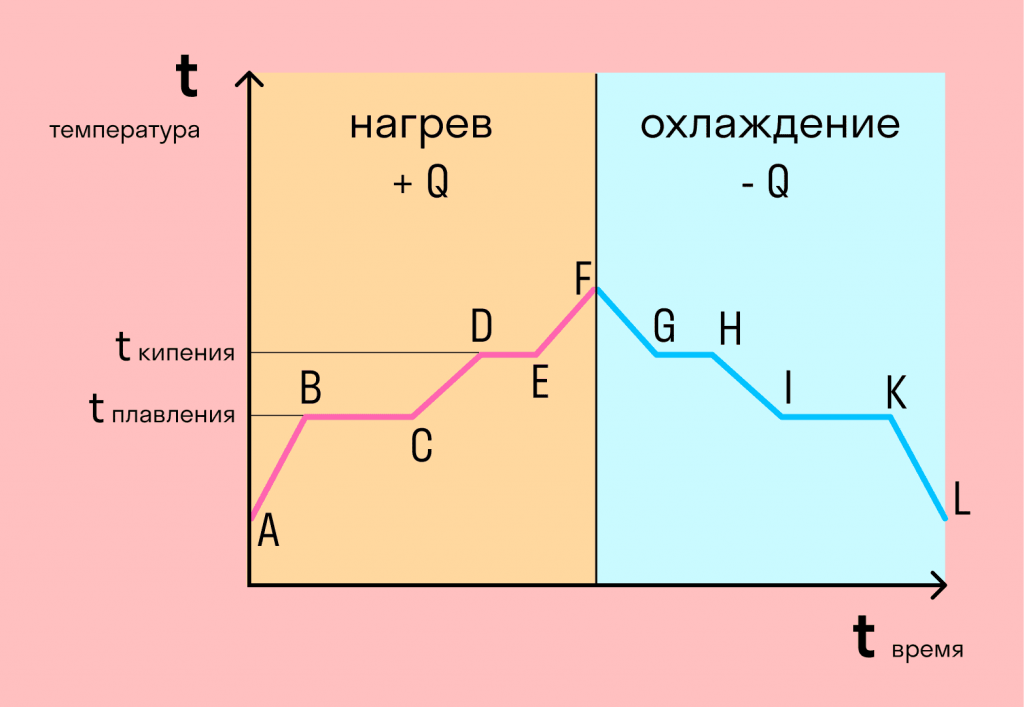
Розбираємося по кроках .
- AB — нагрівання льоду
Спершу взяли лід, звичайно, при негативній температурі, тому що при нулі лід починає плавитися. Нагріли кригу до температури плавлення (до 0 градусів Цельсія).
- BC – плавлення льоду
Після того, як крига нагрілася до температури плавлення, вона починає плавитися. У точці B це ще крига, а в точці C — уже вода. Плавлення відбувається при постійній температурі і тим довше триває, чим більша маса речовини, що плавиться. Ще цей процес залежить від властивостей самої речовини, але про це трохи згодом.
- CD – нагрівання води
Розплавлена речовина вже в рідкому стані знову починає нагріватися і температура збільшується, поки не досягає температури кипіння. У разі нагрівається вода — це, що її температура кипіння дорівнює 100 градусам Цельсія.
- DE – кипіння (пароутворення) води
При 100 градусах вода кипить, поки не википить повністю. У разі процес, як і плавлення, відбувається за постійної температурі. Але пароутворення не можна плутати з випаровуванням, тому що пароутворення відбувається при конкретній температурі, а випаровування – при будь-якій.
- EF — нагрівання пари
Далі отриманий пар нагрівається, але шляхом нагрівання неможливо дійти до іншого фазового переходу — можна піти тільки назад.
- FG — охолодження пари
Перший крок у зворотний бік — охолодження до температури кипіння.
- GH — конденсація пари
Дійшовши до температури кипіння (в даному випадку 100 градусів), пара починає переходити до рідкого стану. Цей процес також відбувається за постійної температури.
- HI — охолодження води
Сконденсувавшись, вода охолоджується, доки не почне замерзати.
- IK — кристалізація води
Кристалізується (замерзає) вода за тієї ж температури, що й плавиться лід — 0 градусів. Кристалізація також відбувається за постійної температури.
- KL – охолодження льоду
Після кристалізації лід охолоджується.
З нагріванням та охолодженням все дуже просто — ми або передаємо теплоту тілу (речовині), і воно йде на підвищення температури, або тіло віддає тепло та охолоджується.
В інших процесах температура не змінюється. Це пов’язано з тим, що кількість теплоти не завжди залежить від температури. Формули для всіх процесів виглядають так:
Нагрівання Q = cm(tкінцева− tпочаткова) Охолодження Q = cm(tпочаткова − tкінцева) Q — кількість теплоти [Дж] c — питома теплоємність речовини [Дж/кг · ˚C ] m — маса [кг] tкінцева — кінцева температура [˚C ] tпочаткова — початкова температура [˚C] |
| Плавлення Q = λm Кристалізація Q = −λm Q — кількість теплоти [Дж] λ — питома теплота плавлення речовини [Дж/кг] m — маса [кг] |
| Пароутворення Q = Lm Конденсація Q = −Lm Q — кількість теплоти [Дж] L – питома теплота пароутворення речовини [Дж/кг] m – маса [кг] |
Рішення задач з фазових переходів
З теорією розібралися – а тепер давайте практикуватися!
Завдання один.Температура мідного зразка масою 100 г підвищилася з 20 до 60 °С. Яку кількість теплоти отримав зразок? Питому теплоємність міді вважати рівною 380 Дж/(кг · °С)
- Спершу потрібно перевести масу в кілограми:
100 г = 0,1 кг
- Беремо формулу кількості теплоти для нагрівання речовини:
Q = cm(tкінцева − tпочаткова)
- Підставляємо числа:
Q = 380 · 0,1 · (60 − 20) = 1520 Дж
Відповідь: зразок отримав 1520 Дж
Завдання два.Яка кількість теплоти необхідна для плавлення 2,5 т сталі, взятої за температури плавлення? Питома теплота плавлення сталі = 80 кДж/кг. Тепловтратами знехтувати.
- Спершу потрібно перевести масу в кілограми та питому теплоту в Дж/кг:
2,5 т = 2500 кг
80 кДж/кг = 80 000 Дж/кг
- Беремо формулу кількості теплоти для плавлення речовини:
Q = λm
- Підставляємо числа:
Q = 80 000 · 2500 = 200 000 000 Дж = 200 МДж
Відповідь:для плавлення 2,5 т сталі необхідно 200 МДж теплоти.
Сублімація і десублімація
Ми вже розповіли про такі процеси, як сублімація і десублімація.
- Перехід з твердого стану в газоподібний, минаючи рідкий – сублімація (вигону);
- Перехід з газоподібного стану в твердий, минаючи рідкий – десублімація.
Приклади з життя Про білизну. Спробуйте повісити білизну сушитися надвір у мороз. Оскільки вода замерзає через низькі температури, білизна має повернутися додому у вигляді великого айсберга, але цього не відбувається — вона повертається абсолютно сухою. У цьому процесі відбулася сублімація молекул води (сублімація). Про принтери. Кольорові принтери (тільки не лазерні) друкують шляхом сублімації. Ось як це працює: частинки фарби швидко переходять із твердого стану в газоподібний і осідають на папері — так виходить кольорова картинка. Малюнки на вікнах. Якщо ви вирішите проїхатися на автобусі в холодну погоду — побачите на шибках чудові візерунки. Через величезну різницю температур між вулицею та автобусом, ми можемо спостерігати процес десублімації у вигляді красивих малюнків на склі. Іній утворюється схожим способом – різке похолодання призводить до десублімації повітря. |
Вологість повітря: випаровування та конденсація
Такі процеси, як випаровування та конденсація, стають більш логічними та простими, якщо їх розглянути на прикладі вологості повітря.
Вологість повітря говорить нам про те, скільки в повітрі міститься водяна пара. Будь-яка кількість пари в повітря не запхнеш, тому, по-перше, її там дуже мало, а по-друге, при надмірній кількості водяної пари відбувається конденсація — це коли утворюється роса.
Допустимо, взимку при температурі -20 градусів в 1 літрі повітря міститься 1 міліграм пара. Відносна вологість у такому разі дорівнює 100% – випаровування не буде, більше пари в це повітря вже не запхнеш. Але якщо ми те саме повітря помістимо в приміщення з температурою +20 градусів, то в нього може випаруватися вже до 17 міліграм пара. Значить, що його вологість дорівнюватиме 1/17 = 6%. Людині комфортніше перебувати при значенні вологості 40–50%.
Як вологість впливає на людину
Для людини вологість дуже важлива, тому що ми складаємося з води на 90%. Якщо навколишньому середовищу нічого випаровувати, вона випаровуватиме нас. Тому при низькій вологості ми відчуваємо сухість у роті, а при високій — волосся вбирає вологу, набухає і починає витися. На цьому принципі збудовано деякі гігрометри — прилади для вимірювання вологості. Вони так і називаються – волосяні гігрометри. Тільки всередині не людське волосся, а кінське, але принцип від цього не змінюється.
При високій вологості холод і тепло сприймаються чутливіше. Це пов’язано з пітливістю людини за високої температури. Такий механізм допомагає нам боротися зі спекою, але при високій вологості піт не може випаруватися. При випаровуванні поту ми втрачаємо надлишкове тепло, а цьому випадку цього не відбувається.
При низькій вологості відбувається щось схоже. Як не дивно, у мороз ми теж потіємо (набагато менше, але все-таки це відбувається). Якщо вологість на вулиці низька, то піт випарується з-під куртки і нам буде комфортно, а при високій вологості – він там затримається і проводитиме тепло назовні, забираючи у нас дорогоцінні тепла Джоулі. Тому взимку в Петербурзі холодніше, ніж у Москві.
Вологістю можна керувати. Існують мішечки з кульками адсорбентами, які кладуть у коробки із взуттям, щоб увібрати зайву вологу. Щоб вікна не запотівали, можна насипати в рами сіль, яка також вбере вологу. А якщо вам навпаки потрібно більше вологи – беремо зволожувач повітря (класна річ!): він додає у повітря водяну пару.





