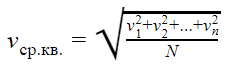Кажуть, що немає межі досконалості, але газ буває ідеальним. Сьогодні ми дізнаємося, що ця фізична модель є і як її використовувати.
Газ: агрегатний стан
У речовин є три агрегатні стани — твердий, рідкий та газоподібний.
Їхні характеристики — у таблиці:
|
Агрегатні стани |
Властивості |
Розташування молекул |
Відстань між молекулами |
Рух молекули |
|---|---|---|---|---|
| Твердий | зберігає форму та об’єм |
в кристалічній решітці |
співвідноситься з розміром молекул< /span> |
коливається біля положення рівноваги в кристалічній решітці |
| Рідкий | зберігає об’єм і плинність |
хаотичний |
близько один до одного |
молекули малорухливі, при нагріванні швидкість руху збільшується |
| Газоподібний | займає весь наданий об’єм |
хаотичний |
більше розмірів молекул |
хаотичне та безперервне |
У житті ми зустрічаємо речовини в газоподібному стані, коли відчуваємо запахи. Запах дуже легко поширюється, тому що газ не має ні форми, ні об’єму (займає весь наданий об’єм) і складається з молекул, що хаотично рухаються, відстань між якими більша, ніж розміри молекул.
Агрегатних станів точно три?
Насправді, є ще четвертий — плазма. Звучить як щось із наукової фантастики, але це просто іонізований газ — газ, у якому, крім нейтральних частинок, є ще й заряджені. Іонізатори повітря якраз будуються на принципі переходу з газоподібної речовини до плазми.
Модель ідеального газу
У фізиці є таке поняття, як модель. Модель — це щось ідеалізоване, воно потрібне у випадках, коли можна знехтувати деякими параметрами об’єкта або процесу.
Ідеальний газ — це модель реального газу. Молекули ідеального газу є матеріальні точки, які взаємодіють друг з одним з відривом, але взаємодіють при зіткненнях друг з одним чи зі стінками посудини. При роботі з ідеальним газом можна знехтувати потенційною енергією молекул (але не кінетичною).
Модель ідеального газу не може описати ситуацію, коли газ стискають так сильно, що він конденсується — переходить у рідкий стан.
У повсякденному житті ідеальний газ, звісно, не зустрічається. Але реальний газ може поводитись майже як ідеальний. Таке трапляється, якщо середня відстань між молекулами у багато разів більша від їх розмірів, тобто якщо газ дуже розріджений.
Властивості ідеального газу
- Відстань між молекулами значно більша розмірів молекул.
- Молекули газу дуже малі і є пружними кулями.
- Сили тяжіння між молекулами зневажливо малі.
- Молекули взаємодіють лише при зіткненнях.
- Молекули рухаються хаотично.
- Молекули рухаються за законами Ньютона.
Середньоквадратична швидкість
Потенційною енергією молекул газу нехтувати можна, а ось кінетичною — ніяк не можна. Тому що кінетична енергія – це енергія руху, а ми не можемо нехтувати швидкістю руху молекул.
На графіку показано розподіл Максвелла – те, як молекули розподіляються за швидкостями. Судячи з графіка, більшість молекул рухаються із середнім значенням швидкості. Хоча є і швидкі, і повільні молекули, просто їх значно менше.
Але наш газ ідеальний, а в ідеальному газі трапляються дива. Одне з таких чудес – те, що всі молекули ідеального газу рухаються з однаковою швидкістю. Ця швидкість називається середньою квадратичною.
| Середня квадратична швидкість
vпор. кв. — середня квадратична швидкість [м/с] v1, v2, v n — швидкість різних молекул [м/с] N — кількість молекул [—] |
Тиск ідеального газу
Молекули газу безладні рухаються. Під час руху вони стикаються одна з одною, а також зі стінками посудини, в якій цей газ знаходиться. Оскільки молекул багато, ударів також багато.
Наприклад, у кімнаті, в якій ви зараз знаходитесь, за одну секунду на кожен квадратний сантиметр молекули повітря завдають стільки ударів, що їх кількість виражається двадцятитризначною кількістю.
Хоча сила удару окремої молекули мала, дія всіх молекул на стінки посудини призводить до значного тиску. Уявіть, що комар намагається штовхати машину – вона не зрушить з місця. Але якщо за роботу візьметься кілька сотень мільйонів комарів, то машину вдасться зрушити.
Експеримент
Щоб змоделювати тиск газу, візьміть пісок і аркуш паперу між двома книгами. Піщини виступатимуть у ролі молекул газу, а лист — у ролі посудини, в якій цей газ знаходиться. Коли ви починаєте сипати пісок на аркуш паперу, папір відхиляється під впливом багатьох піщин. Так само і молекули газу чинять тиск на стінки посудини, в якій знаходяться.

Залежність тиску від інших величин
Залежність тиску від об’єм
У механіці є формула тиску, яка показує, що тиск прямо пропорційний силі і назад пропорційно площі, на яку ця сила виявляється.
| Тиск p = F/S F — сила [Н] S — площа [м2] |
Тобто якщо наші двісті мільйонів комарів штовхатимуть легкову машину, вони розподіляться по меншій площі, ніж якби штовхали вантажний автомобіль, — просто тому, що легковик менший за вантажівку. З формули тиску випливає, що тиск на легковий автомобіль буде більшим через його меншу площу.
Розглянемо аналогічний приклад із двома посудинами різної площі.

Тиск у лівій посудині буде більшим, ніж у другому, тому що його площа менша. А якщо менша площа посудини, то менший і її об’єм. Отже, тиск залежить від об’єму таким чином: що більший об’єм, тим менший тиск, і навпаки.
При цьому залежність буде не лінійна, а набуде такого вигляду (за умови, що температура постійна):
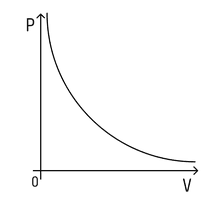
Залежність тиску від об’єму називається законом Бойля-Маріотта. Вона експериментально перевіряється за допомогою такої установки:
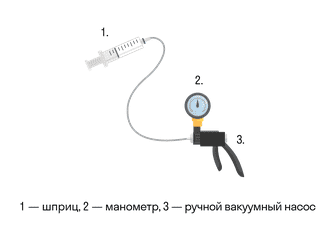
Об’єм шприца збільшують за допомогою насоса, а манометр вимірює тиск. Експеримент показує, що при збільшенні об’єму тиск дійсно зменшується.
Залежність тиску від температури
Розглянемо залежність тиску газу від температури за умови постійного об’єму певної маси газу. Дослідження у цій галузі вперше провів французький винахідник Жак Шарль у XVIII столітті.
У ході експерименту газ нагрівали у великій колбі, з’єднаній з ртутним манометром у вигляді вузької зігнутої трубки. Незначним збільшенням об’єму колби при нагріванні можна знехтувати, як і так само незначною зміною об’єму при зміщенні ртуті у вузькій манометричній трубці. Таким чином, об’єм газу можна вважати незмінним.
Підігріваючи воду в посудині, що оточує колбу, вчений вимірював температуру газу термометром, а тиск — манометром.
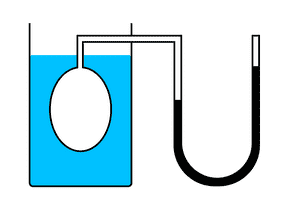
Експеримент показав, що тиск газу збільшується зі збільшенням температури. Це пов’язано з тим, що при нагріванні молекули газу рухаються швидше, через що найчастіше ударяються об стінки посудини.
З температурою все простіше. Залежність тиску від температури при постійних об’ємі і масі буде лінійною:
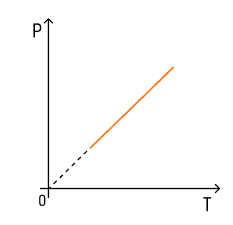
Ця залежність називається законом Шарля на честь вченого, який її відкрив.
Основне рівняння МКТ
Основне завдання молекулярно-кінетичної теорії газу полягає в тому, щоб встановити співвідношення між тиском газу та його мікроскопічними параметрами: масою молекул, їхньою середньою швидкістю та концентрацією. Це співвідношення називається основним рівнянням молекулярно-кінетичної теорії газу або коротко – основним рівнянням МКТ.
В основі молекулярно-кінетичної теорії лежать три положення.
- Усі речовини утворені з найдрібніших частинок – молекул, що складаються з атомів.
Молекули хімічної речовини можуть бути простими та складними, тобто складатися з одного або кількох атомів. Молекули і атоми є електрично нейтральні частинки. За певних умов молекули та атоми можуть набувати додаткового електричного заряду та перетворюватися на позитивні або негативні іони.
- Атоми та молекули перебувають у безперервному хаотичному русі.
- Частини взаємодіють один з одним силами, які мають електричну природу. Гравітаційна взаємодія між частинками дуже мала.
Ми вже з’ясували, що причина тиску газу на стіни – удари молекул. Тиск безпосередньо залежить від кількості молекул – чим їх більше, тим більше ударів об стінки і тим більший тиск. А кількість молекул в одиниці об’єму – це концентрація. Отже, тиск газу залежить від концентрації.
Також тиск пропорційно квадрату швидкості, оскільки чим більша швидкість молекули, тим частіше вона б’ється об стінку посудини. Розрахунки показують, що основне рівняння молекулярно-кінетичної теорії для ідеального газу має такий вигляд.
| Основне рівняння МКТ p=nkT або 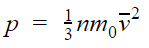 p – тиск газу [Па] n – концентрація [м−3] T – температура газу [К] m0 – маса однієї молекули [кг] v — середня квадратична швидкість [м/с] |
Коефіцієнт 1/3 обумовлений тривимірністю простору: під час хаотичного руху молекул всі три напрямки рівноправні.
Важливий нюанс: середня квадратична швидкість сама по собі не в квадраті! Її формула зазначена вище, а в основному рівнянні МКТ (та й не лише в ньому) вона зведена у квадрат. Це означає, що формулу середньої квадратичної швидкості потрібно підставляти не замість v2, а замість v — і вже зводити цю формулу в квадрат. Це часто провокує плутанину.
Ми знаємо, що кінетична енергія обчислюється за такою формулою:
| Кінетична енергія Ек = mv2/2 Ек – кінетична енергія [Дж] m – маса тіла [кг] v — швидкість [м/с] |
Для молекули газу формула набуде вигляду:
| Середня кінетична енергія поступального руху молекули Ек = m0v2/2 Ек – середня кінетична енергія поступального руху молекули [Дж] m0 – маса молекули [кг] v — швидкість молекули [м/с] |
З цієї формули можна виразити m0v2 і підставити основне рівняння МКТ. Підставимо та отримаємо, що тиск ідеального газу пропорційно до твору концентрації молекул на середню кінетичну енергію поступального руху молекули.
Основне рівняння МКТ 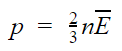 p – тиск газу [Па] n— концентрація [м−3] E — середня кінетична енергія поступального руху молекули [Дж] |
Зберігання та транспортування газів
Якщо потрібно перевезти значну кількість газу з одного місця в інше або якщо газ необхідно довго зберігати, його поміщають у спеціальні міцні металеві посудини. Через те, що при зменшенні об’єму збільшується тиск, газ можна закачати в невеликий балон, але він має бути дуже міцним.
Посудини, призначені для транспортування газів, витримують високий тиск. Тому за допомогою спеціальних насосів (компресорів) туди можна закачати значні маси газу, які в звичайних умовах займали б у сотні разів більший об’єм.
Оскільки тиск газів у балонах навіть за кімнатної температури дуже великий, їх у жодному разі не можна нагрівати. Наприклад, тримати під прямими променями сонця або намагатися зробити в них отвір навіть після використання.