Без газу наш світ виглядав би інакше: ніхто не міг би дихати, атмосфери б не існувало, смішних голосів через гелію б не виходило. Найважливіша характеристика цього агрегатного стану – тиск. Про нього у цій статті.
Газ: агрегатний стан
У світі є три агрегатні стани – твердий, рідкий та газоподібний. Їх характеристики — у таблиці
| Агрегатні стани | Властивості | Розташування молекул | Відстань між молекулами | Рух молекули |
| Твердий | зберігає форму та об’єм | у кристалічній решітці | співвідноситься з розміром молекул | коливається біля свого положення рівноваги в кристалічній решітці |
| Рідкий | зберігає об’єм і текучість | хаотично | близько один до одного | малорухливі, при нагріванні швидкість руху молекул збільшується |
| Гази | займають весь наданий об’єм | хаотично | більше розмірів молекул | хаотичне та безперервне |
У житті ми зустрічаємо газоподібний стан речовини, коли відчуваємо запахи. Запах дуже легко розповсюджується, тому що газ не має ні форми, ні об’єму (він займає весь наданий йому об’єм), складається з хаотично рухомих молекул, відстань між якими більша, ніж розміри молекул.
Агрегатних стани точно три? Насправді, є ще четвертий — плазма. Звучить, як щось із наукової фантастики, але це просто іонізований газ — газ, у якому, крім нейтральних частинок, є ще та заряджені. Іонізатори повітря будуються на принципі переходу з газоподібної речовини до плазми.
Тиск газу
Ми щойно з’ясували, що молекули газу безладно рухаються. Під час руху вони стикаються одна з одною, а також зі стінками посудини, в якій цей газ знаходиться. Оскільки молекул багато, ударів також багато.
Наприклад, у кімнаті, в якій ви зараз знаходитесь, на кожен квадратний сантиметр за 1 з молекулами повітря наноситься стільки ударів, що їхня кількість виражається двадцяти трицифровим числом.
Хоча сила удару окремої молекули мала, дія всіх молекул стінки посудини призводить до значного тиску. Це якби один комар штовхав машину, то вона б і не зрушила з місця, а от пару сотень мільйонів комарів цілком здатні цю машину зрушити.
Залежність тиску від інших величин
Залежність тиску від об’єм
У механіці є формула тиску, яка показує: тиск прямо пропорційно силі і обернено пропорційно площі, на яку ця сила виявляється.
| Тиск p = F/S p — тиск [Па] |
Тобто, якщо наші двісті мільйонів комарів штовхатимуть легкову машину, вони розподіляться по меншій площі, ніж якби вони штовхали вантажний автомобіль (просто тому що легкова менша за вантажівку).
З формули тиску випливає, що тиск на легковий автомобіль буде більшим через меншу площу.
Давайте розглянемо аналогічний приклад із двома посудинами різної площі.

Тиск у лівій посудині буде більшим, ніж у другій, за аналогічною схемою — тому що площа менша. Але якщо площа основи менша, то й об’єм менший. Це означає, що тиск залежатиме від об’єму наступним чином: що більший об’єм, тим менший тиск — і навпаки.
При цьому залежність буде не лінійна, а набуде такого вигляду ( за умови, що температура постійна):
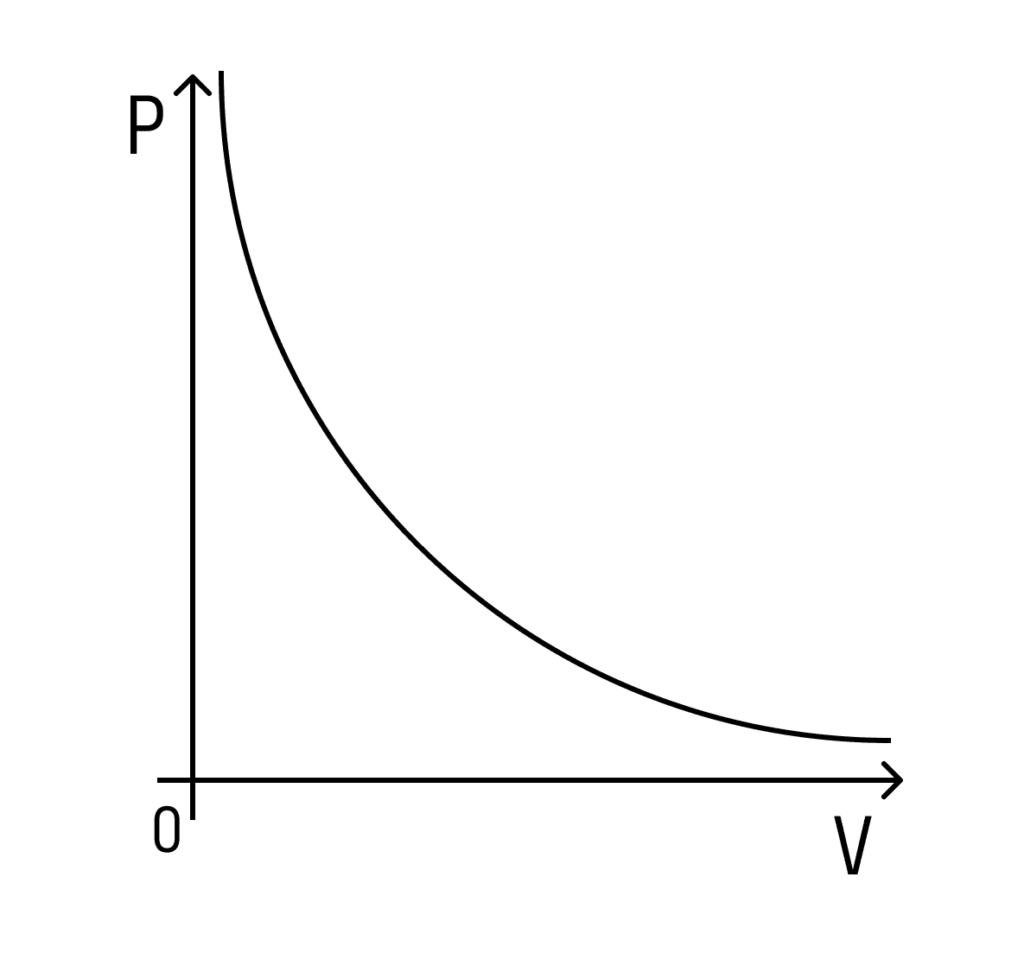
Така залежність називається законом Бойля-Маріотта.
Вона експериментально перевіряється за допомогою такої установки.
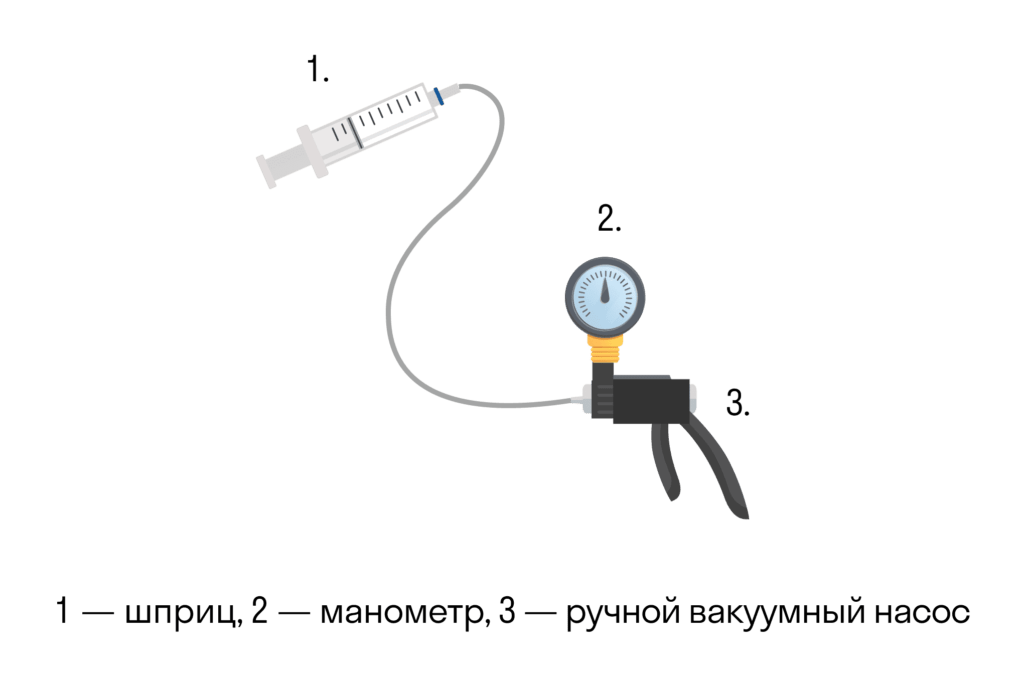
Об’єм шприца збільшують з допомогою насоса, а манометр вимірює тиск. Експеримент показує, що зі збільшенням об’єму тиск дійсно зменшується.
Залежність тиску від температури
Розглянемо залежність тиску газу від температури за умови постійного об’єму певної маси газу. Ці дослідження були вперше зроблені Жаком Шарлем.
Газ нагрівався у великій колбі, з’єднаній із ртутним манометром у вигляді вузької зігнутої трубки. Нехтуючи мізерним збільшенням об’єму колби при нагріванні та незначною зміною об’єму при зміщенні ртуті у вузькій манометричній трубці.
Таким чином, можна вважати об’єм газу незмінним. Підігріваючи воду в посудині, що оточує колбу, вимірювали температуру газу за термометром, а відповідний тиск – за манометром.

Цей експеримент показав, що тиск газу збільшується з збільшенням температури. Це з тим, що з нагріванні молекули газу рухаються швидше, через що частіше ударяються об стінки посудини.
З температурою все простіше. Залежність тиску від температури при постійних об’ємі та масі буде лінійною:
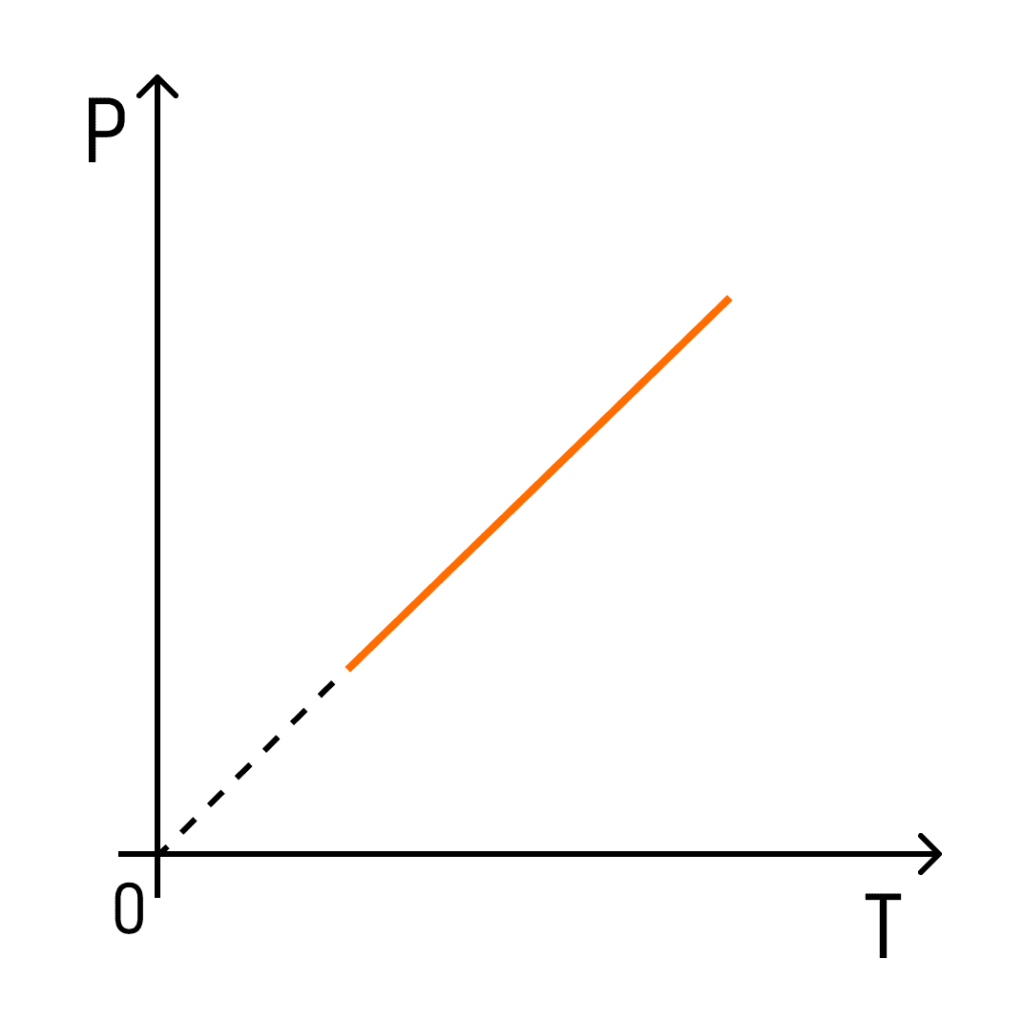
Ця залежність називається законом Шарля.
Зберігання та транспортування газів
Якщо потрібно перевезти значну кількість газу з одного місця в інше, або коли гази необхідно довго зберігати — їх поміщають у спеціальні міцні металеві посудини. Через те, що при зменшенні об’єму збільшується тиск, газ можна закачати в невеликий балон, але він має бути дуже міцним.
Посудини, призначені для транспортування газів, витримують високий тиск. Тому за допомогою спеціальних насосів (компресорів) туди можна закачати значні маси газу, які за звичайних умов займали б у сотні разів більший об’єм.
Оскільки тиск газів у балонах навіть при кімнатній температурі дуже великий, їх у жодному разі не можна нагрівати. Наприклад, тримати під прямими променями сонця або у будь-який спосіб намагатися зробити в них отвір, навіть після використання.





